Lai varētu runāt visaptveroši par hemoglobīnu (Hb), ir lietderīgi vispirms risināt ar mioglobīnu (Mb), kas ir ļoti līdzīgs hemoglobīnam, bet ir daudz vienkāršāks. Pastāv stingras radniecības attiecības starp hemoglobīnu un mioglobīnu: abas ir konjugētas olbaltumvielas un to protēžu grupa (ne-olbaltumvielu daļa) ir heme grupa.
Myoglobīns ir globulārs proteīns, kas sastāv no viena simt piecdesmit aminoskābju ķēdes (atkarībā no organisma) un tā molekulmasa ir aptuveni 18 Kd.
Kā jau minēts, tas ir aprīkots ar hemgrupu, kas ievietota proteīna hidrofobā (vai lipofīlā) daļā, kas sastāv no salocījumiem, kas attiecināmi uz šķiedru olbaltumvielu α-spirāles struktūrām.
Myoglobīnu veido galvenokārt α-helikātu segmenti, kas sastopami astoņos un sastāv gandrīz tikai no polāriem atlikumiem (leicīns, valīns, metionīns un fenilalanīns), bet polārie atlikumi praktiski nav (aspartīnskābe, glutamīnskābe, lizīns un arginīns); vienīgie polārie atlikumi ir divi histidīni, kuriem ir būtiska loma skābekļa uzbrukumā hemgrupai.
Hemgrupa ir hromofora grupa (absorbē redzamajā) un ir funkcionālā mioglobīna grupa.
Skatīt arī: glikozēts hemoglobīns - hemoglobīns urīnā
Nedaudz ķīmija

Saikne starp protoporfirīnu un dzelzi ir tā saukto koordinācijas savienojumu tipiska saite, kas ir ķīmiski savienojumi, kuros centrālais atoms (vai jonu) veido saiknes ar citām ķīmiskajām sugām, kas ir lielākas par tās oksidācijas numuru (elektriskā lādiņa). Hēmas gadījumā šīs obligācijas ir atgriezeniskas un vājas.
Dzelzs koordinācijas numurs (koordinācijas saišu skaits) ir seši: ap dzelzi var būt sešas molekulas, kurām ir kopīgi savienojošie elektroni.
Lai izveidotu koordinācijas savienojumu, ir nepieciešami divi orbitāli ar pareizu orientāciju: viens var nopirkt elektronus un otrs - ziedot tos
Hemā dzelzs veido četras plaknes saites ar četriem slāpekļa atomiem, kas atrodas proto-porfirīna gredzena centrā, un piekto saiti ar tuvāko histidīna slāpekli; dzelzs ir sestā brīvā koordinācijas saite un var saistīties ar skābekli.
Kad dzelzs ir brīva jonu formā, tā d- tipa orbitālēm ir vienāda enerģija; mioglobīnā dzelzs jonu saistās ar protoporfirīnu un histidīnu: šīs sugas magnētiski traucē dzelzs orbītas; traucējumu apmērs dažādām orbitālēm būs atšķirīgs atkarībā no to telpiskās orientācijas un traucējošo sugu. Tā kā orbītu kopējai enerģijai ir jāatgriežas pie nemainīga, traucējumi izraisa enerģētisku atdalīšanos starp dažādām orbitālēm: dažu orbītu iegūta enerģija ir līdzvērtīga citu zaudētajai enerģijai.
Ja atdalīšanās, kas notiek starp orbitālēm, nav ļoti liela, ieteicams izmantot augstu spin elektronisko izkārtojumu: savienojošie elektroni cenšas sakārtot paralēlos griezienus vairākos iespējamos apakšlīmeņos (maksimālais daudzums); no otras puses, ja traucējumi ir ļoti spēcīgi un ir liela atšķirība starp orbitālēm, var būt ērtāk savienot savienotājelementus zemākajos enerģijas orbitālos (zems centrifūgas).
Kad dzelzs saistās ar skābekli, molekula nonāk zemā centrifūgā, bet, kad dzelzs ir sestā brīvā koordinācijas saite, molekulai ir augsts spin.
Pateicoties šai atšķirībai spinā, izmantojot spektrālu mioglobīna analīzi, mēs varam saprast, vai ir saistīts skābeklis (MbO2) vai nav (Mb).
Myoglobīns ir muskuļiem raksturīgs proteīns (bet ne tikai muskuļos).
Miooglobīnu iegūst no spermas valis, kurā tas ir liels daudzums un pēc tam attīrīts.
Baļķiem ir elpošana, tāpat kā cilvēkiem: viņiem ir plaušas absorbēt gaisu caur elpošanas procesu; spermas valam ir jābūt tādam iespējami lielam skābekļa daudzumam muskuļos, kas spēj uzkrāt skābekli, piesaistot to tiem esošajam mioglobīnam; tad, kad vaļveidīgais iegremdē, skābeklis tiek izdalīts lēni, jo tā vielmaiņai ir vajadzīgs skābeklis: jo lielāks skābekļa daudzums, ko spermas valis spēj absorbēt, un vairāk skābekļa ir pieejams niršanas laikā.

Lai padarītu gaļu vairāk vai mazāk sarkanu, tas ir hemoproteīnu saturs (tā ir heme, kas padara gaļu sarkano).
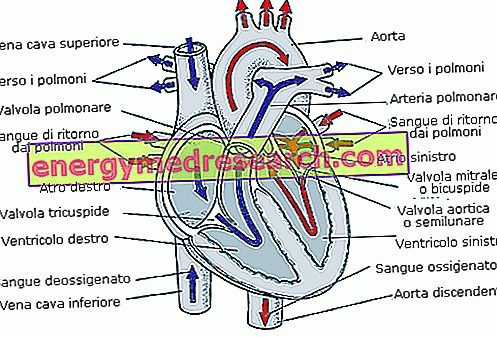
Hemoglobīnam ir daudz strukturālu analoģiju ar mioglobīnu un spēj atgriezeniski saistīt molekulāro skābekli; bet, lai gan myoglobīns attiecas tikai uz muskuļiem un perifērijas audiem, hemoglobīns ir atrodams eritrocītos vai sarkano asins šūnu sastāvā (tās ir pseido šūnas, tas ir, tās nav īstas šūnas), kas veido 40% asins.
Hemoglobīns ir tetrametrs, tas ir, tas sastāv no četrām polipeptīdu ķēdēm, katrs ar hemgrupu un divas - divas (cilvēks ir divas alfa ķēdes un divas beta ķēdes).
Hemoglobīna galvenā funkcija ir skābekļa transportēšana ; cita asins funkcija, kurā ir iesaistīts hemoglobīns, ir vielu transportēšana uz audiem.
Ceļā no plaušām (bagāta ar skābekli) uz audiem hemoglobīns nes skābekli (tajā pašā laikā arī citas vielas nonāk audos), kamēr apgrieztā ceļā tas kopā ar atkritumiem, kas savākti no audiem, jo īpaši oglekļa dioksīdu, kas rodas metabolismā.
Cilvēka attīstībā ir gēni, kas ekspresēti tikai uz noteiktu laiku; šī iemesla dēļ mums ir dažādi hemoglobīni: pieauguša cilvēka auglis, embrija.
Ķēdēm, kas veido šos dažādos hemoglobīnus, ir dažādas struktūras, bet ar līdzīgām funkcijām, ko tās veic, ir vairāk vai mazāk vienādas.
Dažādu dažādu ķēžu klātbūtnes skaidrojums ir šāds: organismu evolūcijas procesā hemoglobīns ir attīstījies arī specializējoties skābekļa transportēšanā no teritorijām, kurās ir bagāti trūkumi. Evolūcijas ķēdes sākumā hemoglobīns veica skābekli mazos organismos; evolūcijas gaitā organismi ir sasnieguši lielākus izmērus, tāpēc hemoglobīns ir mainījies, lai varētu transportēt skābekli uz teritorijām, kas atrodas tālāk no vietas, kurā tas bija bagāts; lai to izdarītu, evolucionāro procesu gaitā ir kodificētas jaunas ķēdes struktūras, kas veido hemoglobīnu.
Myoglobīns saistās ar skābekli pat nelielos spiedienos; perifēros audos ir spiediens (PO2), kas ir aptuveni 30 mmHg: pie šī spiediena myoglobīns neizdala skābekli, tāpēc tas būtu neefektīvs kā skābekļa nesējs. No otras puses, hemoglobīnam ir elastīgāka uzvedība: tas sasaista skābekli augstā spiedienā un atbrīvo to, kad spiediens samazinās.
Ja proteīns ir funkcionāli aktīvs, tas var nedaudz mainīt tā formu; piemēram, skābekli saturošam mioglobīnam ir atšķirīgs forma nekā bez skābekļa saturoša mioglobīna, un šī mutācija neietekmē blakus esošās.
Diskurss ir atšķirīgs attiecībā uz saistītām olbaltumvielām, piemēram, hemoglobīnu: kad ķēde ir oksidēta, tiek ierosināts mainīt tās formu, bet šī modifikācija ir trīsdimensiju, tāpēc arī ietekmē citas tetrametra ķēdes. Fakts, ka ķēdes ir saistītas viena ar otru, liek domāt, ka vienas modifikācijas ietekmē arī citas kaimiņvalstis, pat ja tās atšķiras; ja ķēde ir skābekļa savienojumā, pārējās tetrametra ķēdes uzņemas "mazāk naidīgu attieksmi" pret skābekli: grūtības, ar kurām ķēdes skābekļa savienojumi samazinās, kad ķēdes atrodas pie tās, oksidē sevi. Tas pats arguments attiecas uz deoksidāciju.
Deoksihemoglobīna kvaternāro struktūru sauc par T (saspringto) formu, bet oksihemoglobīna - R formu (atbrīvo); izstieptajā stāvoklī ir virkne diezgan spēcīgu elektrostatisko mijiedarbību starp skābes aminoskābēm un bāziskām aminoskābēm, kas noved pie stingras deoksihemoglobīna struktūras (tāpēc "saspringta forma"), bet, kad skābeklis ir saistīts, šo organismu vienība mijiedarbība samazinās (tāpēc "atbrīvotā forma"). Turklāt, ja nav skābekļa, histidīna lādiņu (skatīt struktūru) stabilizē pretēja aspartīnskābes uzlāde, bet, skābekļa klātbūtnē, ir tendence proteīnam zaudēt protonu; tas viss nozīmē, ka skābekli saturošais hemoglobīns ir spēcīgāka skābe nekā dezoksigenēta hemoglobija: bohr efekts .
Atkarībā no pH, heme grupa vairāk vai mazāk viegli saistās ar skābekli: skābā vidē hemoglobīns vieglāk izdala skābekli (saspringta forma ir stabila), bet pamata vidē saite ar skābekli ir spēcīgāka.

Katrs hemoglobīns izdala 0, 7 protonus uz vienu ienākošo skābekļa molu (O2).
Bohr efekts ļauj hemoglobīnam uzlabot spēju pārvadāt skābekli.
Hemoglobīnam, kas padara braucienu no plaušām uz audiem, jābūt līdzsvaram atbilstoši spiedienam, pH un temperatūrai.
Mēs redzam temperatūras ietekmi .
Temperatūra plaušu alveolos ir apmēram 1-1, 5 ° C zemāka par ārējo temperatūru, bet muskuļos temperatūra ir aptuveni 36, 5-37 ° C; paaugstinoties temperatūrai, piesātinājuma koeficients samazinās (ar tādu pašu spiedienu): tas notiek tāpēc, ka kinētiskā enerģija palielinās un tiek panākta disociācija.

Pastāv arī citi faktori, kas var ietekmēt hemoglobīna spēju saistīties ar skābekli, no kuriem viens ir 2, 3-bifosoglicerāta koncentrācija .
2, 3-bifosoglicerāts ir vielmaiņas līdzeklis, kas atrodas eritrocītos 4-5 mM koncentrācijā (nevienā citā ķermeņa daļā tā nav tik liela, ka tā ir tik liela).
Pie fizioloģiskā pH 2, 3-bifosoglicerāts ir deprotonēts un tam ir pieci negatīvi lādiņi; tas iet uz ķīli starp divām hemoglobīna beta ķēdēm, jo šīm ķēdēm ir augsta pozitīvo lādiņu koncentrācija. Elektrostatiskā mijiedarbība starp beta ķēdēm un bisfosfikalizāta ķēdēm piešķir sistēmai noteiktu stingrību: tiek iegūta saspringta struktūra, kurai ir maz afinitātes pret skābekli; skābekļa oksidēšanas laikā tiek izvadīts 2, 3-bifosoglicerāts.
Eritrocītos ir īpašs aparāts, kas pārvērš 1, 3-bifosoglicerātu (ko rada metabolisms) par 2, 3-bifosoglicerātu tā, lai tas sasniegtu 4-5 mM koncentrāciju, un tādēļ hemoglobīns spēj apmainīties ar l skābekli audos.
Hemoglobīns, kas nonāk audos, ir atbrīvotā stāvoklī (saistīts ar skābekli), bet audu tuvumā tas ir karboksilēts un nonāk izstieptā stāvoklī: proteīnam šajā stāvoklī ir mazāka tendence saistīties ar skābekli, salīdzinot ar atbrīvoto stāvokli, hemoglobīns izdala skābekli audos; turklāt, ņemot vērā reakciju starp ūdeni un oglekļa dioksīdu, rodas H + jonu ražošana, tāpēc bohr efekta dēļ vēl vairāk skābekļa.
Oglekļa dioksīds izkliedējas eritrocītos, kas šķērso plazmas membrānu; ņemot vērā, ka eritrocīti veido aptuveni 40% no asinīm, mums vajadzētu sagaidīt, ka tikai 40% no oglekļa dioksīda, kas izkliedējas no audiem, nonāk tiem, patiesībā 90% oglekļa dioksīda iekļūst sarkanajās asins šūnās, jo tie satur fermentu, kas pārvērš oglekļa dioksīds ogļskābē, no tā izriet, ka stacionārā oglekļa dioksīda koncentrācija eritrocītos ir zema un tādēļ ieiešanas ātrums ir augsts.

Vēl viena parādība, kas rodas, kad eritrocīts sasniedz audu, ir šāds: pēc gradienta HCO3- (oglekļa dioksīda atvasinājums) izdalās no eritrocītiem un, lai līdzsvarotu negatīvā lādiņa izeju, mums ir hlorīdu ievadīšana, kas nosaka osmotiskā spiediena pieaugumu: lai līdzsvarotu šo variāciju, ir arī ūdens iekļūšana, kas izraisa eritrocītu pietūkumu (HAMBURGER efekts). Pretējā parādība rodas, ja eritrocīts sasniedz plaušu alveolu: rodas eritrocītu deflācija (HALDANE efekts). Tādējādi venozie eritrocīti (tieši uz plaušām) ir mazāki par artēriju.