Apskatīt ķīmiju
Olbaltumvielas var ievietot pirmajā vietā "bioloģiskajā pasaulē", jo, ņemot vērā to daudzās funkcijas, nebūtu dzīvības bez tiem.
Olbaltumvielu elementu analīze sniedz šādas vidējās vērtības: 55% oglekļa, 7% ūdeņraža un 16% slāpekļa; ir skaidrs, ka olbaltumvielas atšķiras viena no otras, bet to vidējais elementu sastāvs nedaudz atšķiras no iepriekš norādītajām vērtībām.
Konstitucionāli proteīni ir makromolekulas, kas veidojas no dabīgām α-aminoskābēm; Aminoskābes apvienojas ar amīda saiti, kas tiek veidota, reaģējot uz a-aminoskābes aminoskābju un citas a-aminoskābes karboksilu. Šo saiti (-CO-NH-) sauc arī par peptīdu saiti, jo tas saistās ar peptīdiem (aminoskābes kombinācijā):

iegūtais ir dipeptīds, jo to veido divas aminoskābes. Tā kā dipeptīds satur brīvu amino grupu vienā galā (NH2) un karboksilgrupu (COOH), tas var reaģēt ar vienu vai vairākām aminoskābēm un stiept ķēdi gan no labās, gan no kreisās puses, ar to pašu reakciju, kas redzama iepriekš.
Reakciju secība (kas jebkurā gadījumā nav tik vienkārša) var turpināties bezgalīgi: līdz ir polimērs vai proteīns . Atšķirība starp peptīdiem un proteīniem ir saistīta ar molekulmasu: parasti molekulmasu gadījumā, kas pārsniedz 10 000, to sauc par proteīnu.
Aminoskābju sasaistīšana, lai iegūtu pat mazus proteīnus, ir sarežģīta darbība, lai gan nesen tika izstrādāta automātiska metode proteīnu iegūšanai no aminoskābēm, kas dod lieliskus rezultātus.
Tāpēc visvienkāršākais proteīns sastāv no 2 aminoskābēm: pēc starptautiskās konvencijas proteīnu struktūrā sakārtotā aminoskābju numerācija sākas ar aminoskābēm ar brīvo a-amino grupu.
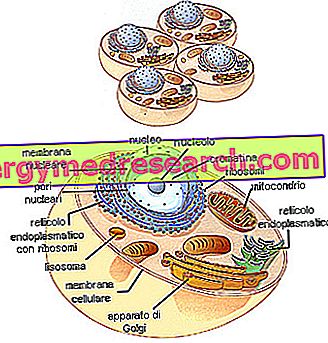
Olbaltumvielu struktūra
Olbaltumvielu molekulas ir veidotas tā, ka mēs varam redzēt līdz četrām atšķirīgām organizācijām: tās parasti izceļas, primāro struktūru, sekundāro, terciāro un kvaternāru.
Primārās un sekundārās struktūras ir būtiskas proteīniem, bet terciārās un kvaternārās struktūras ir "aksesuārs" (tādā nozīmē, ka ne visas olbaltumvielas var tās aprīkot).
Primāro struktūru nosaka aminoskābju skaits, veids un secība proteīnu ķēdē; tādēļ ir nepieciešams noteikt kārtējo aminoskābju secību, kas veido olbaltumvielu (lai zinātu, ka tas nozīmē zināt precīzu DNS bāzu secību, kas kodē šo proteīnu), kas saskaras ar nenozīmīgām ķīmiskām grūtībām.
Pēc Edmana degradācijas bija iespējams noteikt kārtējo aminoskābju secību: proteīns reaģē ar fenilizotiocianātu (FITC); sākotnēji a-amino slāpekļa dublets uzbrūk fenilizotiocianātam, veidojot tiokarbamila atvasinājumu; pēc tam iegūtie produkti cikliski dod feniltioidantoīna atvasinājumu, kas ir fluorescējošs.
Edman ir izstrādājis mašīnu, ko sauc par sekvenceri, kas automātiski pielāgo parametrus (laiku, reaģentus, pH utt.) Degradācijai un nodrošina proteīnu primāro struktūru (šim nolūkam viņš saņēma Nobela prēmiju).
Primārā struktūra nav pietiekama, lai pilnībā interpretētu proteīnu molekulu īpašības; tiek uzskatīts, ka šīs īpašības būtībā ir atkarīgas no telpiskās konfigurācijas, ko proteīnu molekulas mēdz uzņemties, liekoties dažādos veidos: tas ir, pieņemot, kas ir definēts kā proteīnu sekundārā struktūra. Olbaltumvielu sekundārā struktūra ir tremolabils, ti, tā mēdz atbrīvoties no sildīšanas; tad olbaltumvielas ir denaturētas, zaudējot daudzas to raksturīgās īpašības. Papildus uzsildīšanai virs 70 ° C denaturāciju var izraisīt arī apstarošana vai reaģentu (piemēram, stipru skābju) iedarbība.
Olbaltumvielu denaturācija ar termisko efektu tiek novērota, piemēram, karsējot olu baltumus: tiek uzskatīts, ka tā zaudē želejveida izskatu un kļūst par nešķīstošu baltu vielu. Tomēr olbaltumvielu denaturācija noved pie to sekundārās struktūras iznīcināšanas, bet primārā struktūra (dažādu aminoskābju saķere) paliek nemainīga.
Olbaltumvielas iegūst terciāro struktūru, ja to ķēde, kaut arī joprojām ir elastīga, neraugoties uz sekundārās struktūras salocīšanu, salocās tā, lai izveidotu vītā trīsdimensiju izkārtojumu cietā korpusa veidā. Disertulfīdu saites, kuras var izveidot starp molekulā izkliedēto cisteīnu -SH, galvenokārt ir atbildīgas par terciāro struktūru.
No otras puses, kvaternārā struktūra konkurē tikai par proteīniem, ko veido divas vai vairākas apakšvienības. Piemēram, hemoglobīns sastāv no diviem proteīnu pāriem (tas ir, visos četrās olbaltumvielu ķēdēs), kas atrodas tetrahedrona virsotnēs tādā veidā, kas rada sfēriskas formas struktūru; četras olbaltumvielu ķēdes tur kopā ar jonu spēkiem, nevis kovalentām saitēm.
Vēl viens kvaternārās struktūras piemērs ir insulīna, kas, šķiet, sastāv no sešiem proteīna apakšvienībām, kas sakārtotas pāros trijstūra virsotnēs, kuru centrā atrodas divi cinka atomi.
PROTEĪNI FIBROSE: tie ir proteīni, kam ir noteikta stingrība un kuru asis ir daudz garākas nekā otrs; visbiežāk sastopamais šķiedru proteīns ir kolagēns (vai kolagēns).
Šķiedru olbaltumvielai var būt vairākas sekundārās struktūras: α-spirāle, β-brošūra un kolagēna gadījumā trīskāršā spirāle; α-spirāle ir visstabilākā struktūra, kam seko β-brošūra, bet vismazāk stabila no trim ir trīskāršā spirāle.
α-helix
Tiek uzskatīts, ka propellers ir labās puses, ja pēc galvenā skeleta (virzienā no apakšas uz augšu) tiek veikta kustība, kas līdzīga labās puses skrūves skrūvei; ja dzenskrūve ir kreisajā rokā, ja kustība ir līdzīga kreisās puses skrūves skrūvei. Labās puses α-helikātos aminoskābju -R aizvietotāji ir perpendikulāri olbaltumvielu galvenajai asij un saskaras uz āru, bet kreisajā pusē a-spirāles aizvietotāji -R saskaras uz iekšu. Labās puses spirāles ir stabilākas nekā kreisās puses, jo starp tvertnēm -R ir mazāk mijiedarbības un mazāk steriska šķēršļa. Visi proteīnos atrastie α-spirāļi ir dekstrogēni.
Α-spirāles struktūru stabilizē ūdeņraža saites (ūdeņraža tilti), kas veidojas starp katras aminoskābes karboksilgrupu (-C = O) un aminogrupu (-NH), kas ir četri atlikumi vēlāk. lineāra secība.
Piemērs proteīnam ar α-spirāles struktūru ir matu keratīns.
β-sheet
Β-brošūras struktūrā ūdeņraža saites var veidoties starp aminoskābēm, kas pieder pie dažādām, bet paralēlām polipeptīdu ķēdēm, vai starp tās pašas olbaltumvielas aminoskābēm pat skaitliski tālu viena no otras, bet plūst pretparalēlos virzienos. Tomēr ūdeņraža saites ir vājākas nekā tās, kas stabilizē α-spirāles formu.
Β-brošūras struktūras piemērs ir zīda fibrīns (tas ir atrodams arī zirnekļu tīklos).
Paplašinot α-spirāles struktūru, tiek veikta pāreja no α-spirāles uz β-bukletu; arī siltums vai mehāniskā spriedze ļauj pāriet no α-spirāles struktūras uz β-loksnes struktūru.
Parasti proteīnā β-bukletu struktūras ir tuvu viena otrai, jo var izveidot ūdeņraža saites starp proteīna daļām.
Šķiedrainā olbaltumvielās lielākā daļa proteīna struktūras ir organizēta kā α-spirāle vai β-brošūra.
GLOBULĀRIE PROTEĪNI: tiem ir gandrīz sfēriska telpiskā struktūra (sakarā ar daudzajām polipeptīda ķēdes virziena izmaiņām); Dažas būtnes daļas var izsekot līdz α-spirāles vai β-brošūras struktūrai, un citas daļas nav attiecināmas uz šīm formām: izkārtojums nav nejaušs, bet organizēts un atkārtojas.
Līdz šim minētās olbaltumvielas ir pilnīgi homogēnas konstitūcijas vielas, ti, kombinēto aminoskābju tīrās sekvences; šos proteīnus sauc par vienkāršiem ; ir olbaltumvielas, kas sastāv no olbaltumvielu daļas un ar proteīnu nesaistītas daļas (prostatas grupas), ko sauc par konjugētiem proteīniem.
Kolagēna
Tā ir visbiežāk sastopamā olbaltumviela: tā atrodas kaulu, naglu, radzenes un acs lēcās starp dažu orgānu (piemēram, aknu) intersticiālajām telpām utt.
Tās struktūra dod tai īpašas mehāniskās spējas; tai ir liela mehāniskā pretestība, kas saistīta ar augstu elastību (piemēram, cīpslām) vai augstu stingrību (piemēram, kaulos) atkarībā no funkcijas, kas tai ir jāveic.
Viena no visdažādākajām kolagēna īpašībām ir tās vienkāršā vienkāršība: tā veidojas apmēram 30% ar prolīnu un apmēram 30% glicīnu ; pārējās 18 aminoskābes jāsadala tikai atlikušajos 40% proteīna struktūras. Kolagēna aminoskābju secība ir ārkārtīgi regulāra: katrs trešais atlikums, trešais ir glicīns.
Prolīns ir cikliska aminoskābe, kurā R grupa saistās ar α-amino slāpekli, un tas dod zināmu stingrību.
Galīgā struktūra ir atkārtota ķēde ar spirāles formu; kolagēna ķēdē nav ūdeņraža saites. Kolagēns ir kreisā spirāle ar soli (garums, kas atbilst spirāles revolūcijai) lielāks nekā α-spirāle; kolagēna spirāle ir tik vaļīga, ka trīs olbaltumvielu ķēdes spēj savstarpēji ietīt vienu virvi: trīskāršu spirāles struktūru.
Kolagēna trīskāršā spirāle tomēr ir mazāk stabila nekā α-spirāles struktūra un β-bukleta struktūra.
Tagad aplūkosim mehānismu, ar kuru tiek ražots kolagēns ; apsveriet, piemēram, asinsvadu plīsumu: šo pārrāvumu pavada neskaitāmi signāli, lai aizvērtu trauku, tādējādi veidojot recekli. Koagulācijai ir nepieciešami vismaz trīsdesmit specializēti fermenti. Pēc trombiem ir jāturpina audu remonts; šūnas, kas atrodas tuvu brūcei, rada arī kolagēnu. Lai to izdarītu, vispirms tiek ierosināts gēna izpausme, tas ir, organismi, kas sākas no gēna informācijas, spēj ražot proteīnu (ģenētiskā informācija tiek pārrakstīta uz mRNS, kas nāk no kodolā un nonāk citoplazmā esošajās ribosomās, kur ģenētiskā informācija tiek pārvērsta proteīnos). Tad kolagēns tiek sintezēts ribosomās (tas parādās kā kreisās puses spirāle, kas sastāv no aptuveni 1200 aminoskābēm un molekulmasa ir aptuveni 150000 d), un pēc tam uzkrājas lūmenos, kur tā kļūst par substrātu fermentiem, kas spēj veikt post modifikācijas. -tradicionāls (mRNS tulkotas valodas izmaiņas); kolagēnā šīs modifikācijas sastāv no dažu sānu ķēžu, jo īpaši prolīna un lizīna oksidēšanās.
Enzīmu neveiksme, kas noved pie šīm izmaiņām, izraisa skorbtu: tā ir slimība, kas sākotnēji izraisa asinsvadu plīsumu, zobu plīsumu, kam var sekot interestestināla asiņošana un nāve; to var izraisīt ilgstošas lietošanas pārtikas nepārtraukta izmantošana.
Pēc tam ar citu fermentu iedarbību notiek citas modifikācijas, kas ietver prolīna un lizīna hidroksilgrupu glikozidēšanu (cukurs ir saistīts ar skābekli ar OH); šie fermenti ir atrodami citās vietās, kas nav lūmenis, tāpēc, kamēr proteīns tiek pārveidots, tas migrē endoplazmatiskā retikulāta iekšpusē, lai nonāktu maisiņos (vezikulās), kas aizveras uz sevi un atdalās no režģa. glikozidētais pro-kolagēna monomērs; pēdējā nonāk pie Golgi aparāta, kur īpaši fermenti atpazīst glikozidētā pro-kolagēna karboksīna daļā esošo cisteīnu un izraisa dažādas ķēdes, lai tās savstarpēji tuvotos un veidotu disulfīda tiltus: trīs pro ķēdes glikozidēts kolagēns, kas savienots kopā, un tas ir sākumpunkts, no kura trīs ķēdes, kas iekļūst, tad spontāni izraisa trīskāršu spirāli. Trīs glikidoksidētās pro-kolagēna ķēdes, kas savienotas viena ar otru, tad vezikula, kas, aizrīšanās uz sevi, atdalās no Golgi aparāta, transportējot trīs ķēdes uz šūnas perifēriju, kur, saplūstot ar plazmas membrānu, trimetro tiek izvadīts no šūnas.
Papildu šūnu telpā ir īpaši enzīmi, pro-kolagēna peptidāzes, kas no šūnas izņemto sugu izņem trīs fragmentus (pa vienam katram spirālam), katrs 300 aminoskābes, katram karboksīda gala pusē un trīs fragmentus (vienu katram no tiem). spirāle), kas katrai ir aptuveni 100 aminoskābes, no aminoskābju daļas: trīskāršā spirāle paliek, kas sastāv no aptuveni 800 aminoskābēm spirālam, kas pazīstams kā tropokollagēns .
Tropokollagēna izskats ir diezgan stingrs; dažādi trimeri ir saistīti ar kovalentām saitēm, lai iegūtu lielākas struktūras: mikrofibrilus . Mikrofibrilos dažādie trimeri ir izvietoti pakāpeniski; tik daudz mikrofibrilu ir tropokollagēna saišķi.
Kaulos, starp kolagēna šķiedrām, ir intersticiālas telpas, kurās nogulsnējas kalcija un magnija sulfāti un fosfāti: šie sāļi arī aptver visas šķiedras; tas padara kaulus stīvus.
Cīpslās intersticiālās telpas ir mazāk bagātas ar kristāliem nekā kauliem, bet mazākas olbaltumvielas ir salīdzinājumā ar tropokollagēnu: tas nodrošina elastību cīpslām.
Osteoporoze ir slimība, ko izraisa kalcija un magnija trūkums, kas neļauj noteikt sāļus tropokollagēna šķiedru intersticiālajās zonās.